Contents
L’ALECA « entraînera certainement une hausse des prix et réduira l’accès à certains médicaments », prévient Oumaima Jegham une chercheuse préparant un mémoire de master intitulée Droit de la propriété intellectuelle et accès aux médicaments, les conséquences possibles de l’ALECA. Ce traité se compose de 11 « catégories » et aucune ne porte sur la santé ou l’industrie pharmaceutique à proprement parler. Cependant, à y voir de plus près, la catégorie « propriété intellectuelle » comprend des articles intitulés : « brevets et santé publique » et « prolongation de la durée de protection conférée par un brevet sur les médicaments ». Des chevaux de Troie ? Le risque existe. Brevets, période de protection additionnelle aux brevets et secret des affaires sont les trois mécanismes qui pourraient avoir un impact sur l’accès aux soins.
Les prolongations de brevets
Selon Jegham, l’exclusivité des données, notamment en matière de brevets, aura un effet considérable sur les prix des médicaments. « La protection est conférée pour une durée limitée, en général 20 ans à compter de la date de dépôt de la demande, » selon l’organisation mondiale de la propriété intellectuelle. A l’issue de cette période, l’objet du brevet tombe dans le domaine public. Dans le milieu de la santé, cela se traduit par les médicaments génériques, des médicaments à bas prix avec le même principe actif. Une aubaine pour les malades mais aussi pour les caisses d’assurances publiques qui remboursent le cas échéant les soins.
ENCADRE 1 – Définition du brevet selon OMPI
Un brevet est un droit exclusif conféré sur une invention. En règle générale, un brevet octroie à son titulaire le droit de décider comment – ou si – l’invention peut être utilisée par des tiers. En contrepartie, le titulaire du brevet met les informations techniques sur l’invention à la disposition du public dans le document de brevet publié.
Source : Organisation mondiale de la propriété intellectuelle – https://www.wipo.int/patents/fr/
Le projet de traité tuniso-européen (ALECA) daté de juillet 2018 prévoit une période de protection complémentaire des propriétés intellectuelles considérant qu’un brevet ne peut être indéfiniment renouvelé. A première vue, cette démarche permettrait de rassurer les investisseurs sur le respect de leurs droits et de leurs propriétés. En 2008, le journal Les Echos justifiait cela ainsi :
« Les brevets sont déposés très en amont de l’exploitation commerciale, avant même l’entrée en développement clinique (essais chez l’homme). Puisqu’il faut de dix à douze ans, à compter de l’identification de la molécule active, pour mettre un produit sur le marché, la durée pendant laquelle la commercialisation est protégée, donc à l’abri des génériques, est au plus de huit à dix ans sur une durée totale du brevet de vingt ans. D’où l’instauration, depuis 1993, du certificat complémentaire de protection (CCP), qui peut allonger jusqu’à cinq ans la durée de protection du brevet » selon le règlement de l’Union Européenne n° 1768/92 du 18 juin 1992.
Cependant, les conséquences de ces délais supplémentaires sont aussi simples que néfastes : plus la période de protection est longue, plus le médicament est cher, moins il est accessible, plus les délais d’accès aux génériques sont longs. Et plus les patients attendent, moins ils ont de chance de (bien) vivre.
Dans les années 2000, les pays asiatiques ont été confrontés aux négociations d’accords de libre-échange. Droit à la vie et à la santé ou droit de la propriété ? Le dilemme schématisé en ces termes est le même auquel la Tunisie est confrontée aujourd’hui. Par exemple, en Inde, le libre-échange et la propriété intellectuelle n’ont pas fait bon ménage. En 2010, le gouvernement et la commission européenne négociaient, à huis clos, les termes d’un accord qui comportait également une extension de la protection de la propriété intellectuelle. Une démarche critiquée par Médecins sans frontières. C’est le traitement contre le VIH/sida qui était en jeu, les citoyens indiens n’étaient pas les seuls concernés. En effet, selon un communiqué de presse sur le site de l’ONG: “l’Inde est à l’origine de 80% des médicaments contre le sida employés dans les projets Médecins Sans Frontières. Sans les médicaments de qualité et à des prix abordables fabriqués en Inde, il aurait été impossible d’étendre le traitement aux niveaux actuels et des millions de vies n’auraient pas été sauvées. »
A la même période, la Thaïlande parvenait à fournir un traitement contre le VIH/Sida, il consiste en une association de trois antirétroviraux. Aucun des trois médicaments n’est breveté dans ce pays. L’accord de libre-échange avec l’association européenne de libre échange (AELE, une association d’États visant à établir une zone de libre-échange en Europe comprenant des pays ne faisant pas partie de l’UE comme la Suisse.) mettait en péril l’accès à deux sortes de médicaments non-brevetés, bien que ce pays asiatique respecte les accords de propriété intellectuelle de l’OMC. In fine, la Thaïlande est loin d’être un pirate, elle met en application des dispositions prévues par l’Organisation Mondiale du Commerce, notamment l’Accord sur les aspects des droits de propriété intellectuelle qui touchent au commerce (ADPIC, en anglais, Agreement on Trade-Related Aspects of Intellectual Property Rights : TRIPS). Les Européens s’avèrent plus restrictifs que l’OMC.
« La licence » en toute franchise
Que faire quand un médicament pouvant sauver des millions de vies humaines est découvert et qu’il coûte trop cher ou existe en quantité limitée ?
A l’image d’un café Starbucks ou d’un fastfood « Baguette et Baguette », l’équivalent des franchises dans le domaine médical, c’est la « licence ». Elle permet a priori de faciliter, d’étendre et d’accélérer l’accès aux médicaments brevetés. Même l’OMPI vante certaines expériences de « licensing » comme un moyen de sauver des vies.
En Tunisie, le leader sur le marché Adwya produit sous licence volontaire plusieurs médicaments comme l’antiobiotique Clamoxyl sous licence du britannique GSK ou Hexomédine sous licence du français Sanofi-Aventis. La production et la commercialisation s’effectuent sous la marque de la multinationale, les revenus de la vente des médicaments sont encaissés par le laboratoire tunisien qui prend en charge : les coûts de production et les royalties (environ 4% des ventes). La rentabilité est jugée élevée dans une Note de recherche de MAC SA, intermédiaire en bourse, février 2008. Adwya s’est longtemps focalisé sur ce créneau, mais s’oriente de plus en plus vers le générique depuis une dizaine d’années. Néanmoins, une source interne estime qu’avec la chute du dinar, l’exclusivité conférée au détenteur du brevet, les marges sur les produits sous licence se réduisent nettement pour Adwya comme pour les autres laboratoires tunisiens. « Pour nous fournir les produits sous licence, les grands laboratoires se fournissent chez des usines indonésiennes ou indiennes pour nous les refacturer au nom de leurs labos à Londres, Paris ou ailleurs. Or, nous nous fournissons chez les mêmes usines pour les génériques. » Si les Tunisiens vendaient des génériques au lieu des « sous-licence », ils pourraient se faire une marge de 30 à 60%, estime-il.
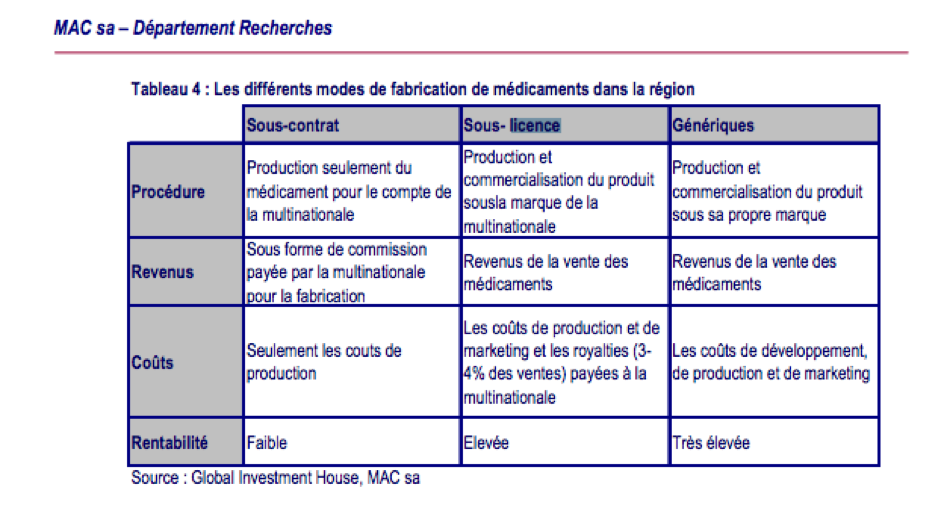
Source : http://www.macsa.com.tn/Downloader?sn=2906
Licence d’office et obligatoire
Contrairement aux franchises, toutes les licences ne sont pas contractuelles ou consensuelles… « Lorsque des raisons d’intérêt général le justifient, les autorités publiques nationales peuvent autoriser l’exploitation d’un brevet par une personne tierce sans le consentement du propriétaire. » Ceci n’est pas une revendication d’un militant mais une affirmation de l’Organisation Mondiale de la Santé (OMS). Il s’agit là d’une suspension temporaire ou permanente du brevet dans un pays. Une sorte de compromis entre d’un côté le droit à la santé et à la vie, et le droit de la propriété privée de l’autre côté.
L’ONG lausannoise Public Eye dénonce la situation de « monopole » conféré par les brevets, estimant que « les pharmas peuvent fixer les prix comme bon leur semble, ou presque. Les gouvernements sont à la fois otages et complices de la toute-puissance des géants de la pharma. » Elle incite les Etats à faire usage de leurs droits, « à l’aide d’un instrument légal, la licence obligatoire, qui permet la mise en vente de génériques moins chers malgré l’existence d’un brevet. »
Autre méthode de garantie du droit d’accès aux soins : la licence d’office. En l’occurrence, le droit français prévoit de faire prévaloir l’intérêt général : « si l’intérêt de la santé publique l’exige » les brevets délivrés pour des médicaments peuvent être soumis au régime de la licence d’office. La loi autorise une telle procédure lorsque les médicaments brevetés « ne sont mis à la disposition du public qu’en quantité ou qualité insuffisante ou à des prix anormalement élevés ».
Et en Tunisie, quel peut être l’impact de l’ALECA ?
Dans une version antérieure rendue publique en avril 2017 et datant d’avril 2016, l’accord prévoyait une protection des données des essais cliniques des médicaments. Or, un médicament ne peut être commercialisé sans tests cliniques. Donc, les Etats ou laboratoires locaux doivent refaire des essais afin de commercialiser un générique… qui est libre de droit par définition.
Cette disposition a suscité de vives critiques, notamment de la part de ITPC Mena une ONG basée à Casablanca qui a pour but de faire valoir l’accès aux soins sur la propriété intellectuelle. Elle consiste en « une protection exclusive des données des essais cliniques pour une durée de 10 ans. Cette clause abusive est une demande quasi systématique de la Commission Européenne dans ses Accords de libre-échange. Si acceptée, cette mesure permettrait aux multinationales de bloquer l’enregistrement de médicaments génériques pendant 5 ans (certains parlent de 10 ans) même en l’absence de brevets. Pire, cette mesure pourrait bloquer l’usage par l’État tunisien d’utiliser son droit d’utiliser des licences obligatoires ou d’office. En effet, si l’Etat lève la protection par le brevet à travers ces licences, il sera impossible d’enregistrer des génériques pendant la durée d’exclusivité des données ce qui reviendrait simplement à neutraliser définitivement l’option d’usage de ce type de licences. »
Dans la version actuelle de l’ALECA (datée de juillet 2018), cette partie a été supprimée. Une victoire ? Pas nécessairement…


Vivement « le secret des affaires » !
Parmi les évolutions observées dans le projet de l’ALECA entre la version de 2016 et la version de juillet 2018, un article intitulé « secret des affaires » a été rédigé et développé.
De quoi s’agit-il ?
Selon le projet, le principe de « secret d’affaires » ce sont des informations qui « ont une valeur commerciale parce qu’elles sont secrètes ». Cette proposition réalisée par la partie européenne considère qu’il est contraire aux usages honnêtes en matière commerciale, par exemple « l’obtention d’un secret d’affaires sans le consentement du détenteur du secret d’affaires, lorsqu’elle est réalisée par le biais d’un accès non autorisé à tout document, objet, matériau, substance ou fichier électronique ou d’une appropriation ou copie non autorisée de ces éléments, que le détenteur du secret d’affaires contrôle de façon licite et qui contiennent ledit secret d’affaires ou dont ledit secret d’affaires peut être déduit. »
Au-delà de la tonalité juridique, le message est clair. Appliqué au domaine médical, le secret des affaires pourrait donner plus de marge de manœuvre aux grands laboratoires pour protéger leurs molécules. C’est une protection plus étendue que le brevet, pouvant lui être alternative.
Dans un guide pratique, la chambre de commerce et d’industrie de Lyon (CCI) encourage les entreprises à se saisir de cette disposition en vigueur en France depuis le 30 juillet 2018 :
« Certes, le brevet confère à son titulaire un droit exclusif pour l’exploitation de l’invention et peut être valorisé par la concession de licences d’utilisation, mais le secret peut lui être préféré. C’est même la solution privilégiée par nombre d’entreprises, et notamment les PME, l’avantage principal étant que les conditions de protection du secret sont beaucoup plus souples que celles relatives aux droits de propriété industrielle : absence de procédures administratives, de taxes, de limites territoriales, de durée… Mais surtout, breveter impose de publier l’invention, qui va donc être connue de la concurrence. »
Les effets secondaires de l’ALECA
Selon Oumaima Jegham, très peu de Tunisiens semblent comprendre le lien entre les droits de propriété intellectuelle et les soins de santé, y compris les entreprises pharmaceutiques nationales et l’équipe de négociation tunisienne elle-même. En avril 2017, les négociateurs tunisiens sur ces questions faisaient partie de l’INNORPI, l’office tunisien des brevets, et du ministère de la santé. Cependant, a dit Jegham, « ils ne sont pas des experts en matière de droits de propriété intellectuelle qui concernent spécifiquement le secteur de la médecine et de la santé ».
« Il y a une inadéquation entre la composition de l’équipe de négociation et les sujets abordés à la table des négociations. Lorsque je participe à des conférences sur l’ALECA, les gens parlent d’immigration, de textile, de technologie, mais personne ne parle de l’accès aux médicaments. Personne ne parle des droits de propriété intellectuelle… des dispositions sur les droits de propriété intellectuelle qui auront aussi des répercussions sur d’autres secteurs, » estime-t-elle. Du côté des professionnels du médicament, certains laboratoires tunisiens ne sont pas informés (et ne s’informent pas ?) de l’évolution des négociations et de la portée médicale du projet de traité tuniso-européen. Si ce texte est adopté en l’état, plus rien ne sera comme avant, ni pour eux, ni pour leurs clients… les Tunisiens.






